Interaktivní a zábavné tábory a kroužky pro děti
Lekce III / 10 - Voda
Cíl lekce:
Žáci získají základní představu o struktuře molekuly vody, o fyzikálně-chemických vlastnostech vody, jejím výskytu na Zemi a jejím významu. V experimentální části si vytvoří model molekuly vody a na příkladech si ukáží hygroskopické pohyby.
Zeptejte se Vašich dětí:
- K čemu používají lidé vodu?
- V jakém skupenství se na Zemi nachází voda?
- Jaké má voda vlastnosti? Jak vypadá?
- Z čeho se skládá molekula vody?
- Do jaké podoby se změní voda, pokud jí ochladíme např. na -5 °C?
- Co se stalo se zápalkami?
Molekula vody
Molekula vzniká spojením jednotlivých atomů mezi sebou. Toto spojení se nazývá chemická vazba. Atomy se nemusí vázat se stejným druhem atomů. Molekula vody se skládá ze dvou atomů vodíku vázaných s jedním atomem kyslíku. Ačkoli se voda, jako každá jiná látka, skládá z atomů, atom vody neexistuje. Nejmenší množství vody, které můžeme získat je molekula vody. Jelikož voda obsahuje více než jeden druh atomu, není to prvek, ale sloučenina.
Voda je nejběžnější a nejrozšířenější látkou na Zemi. Část zemského povrchu s obsahem vody v kapalném skupenství nazýváme hydrosféra. Rozšířením vody na Zemi a jejím pohybem se zabývá hydrologie, pohyb vody v zemské atmosféře zkoumá též meteorologie. Výskyt vody na naší planetě je mnohem vyšší než na ostatních planetách sluneční soustavy. Při pohledu z vesmíru vypadá Země jako modrobílá planeta: bílá od vodní páry a modrá od vody.
Zatímco pevnina zaujímá 29,2 % z povrchu naší planety, oceán se rozkládá na 70,8 % povrchu. Vodní biocyklus má z hlediska evoluce zásadní význam jako výchozí prostředí pro vznik obratlovců. Voda je základní stavební látkou všech organismů. Její podíl na hmotnosti organismů je značný, obvykle 65 % (u lidí) a až 90 % (u rostlin). Člověk se od pradávna zajímal o tajemný život ve vodě. Jeho hlubšímu poznání však bránila nedostatečná technická vybavenost. Teprve v 19. století bylo pomocí dokonalejších přístrojů umožněno uskutečňovat bádání ve vodním prostředí, která vedla postupně k objasňování kvalitativních změn, k nimž dochází v přírodních vodách. Voda je látka výjimečných vlastností. Tyto vlastnosti pramení z uspořádání jejích atomů a jejich vzájemných vazeb. Na chemických vlastnostech vody jsou závislé všechny formy života na Zemi.
Za normální teploty a tlaku je to bezbarvá, čirá kapalina bez zápachu, v silnější vrstvě namodralá. Chemický vzorec vody je H2O. V přírodě se vyskytuje voda ve třech skupenstvích: v pevném led a sníh, v kapalném – voda a v plynném – vodní pára. Molekula vody se skládá z centrálního atomu kyslíku a dvou atomů vodíku. Je to lomená molekula odvozená z hybridizace sp3 s úhlem blízkým tetraedrickému (109,5) – má tedy tvar rovnoramenného trojúhelníka. Experimentálně však bylo zjištěno, že molekula vody je lomená a úhel mezi vazbami O-H je 104,45º. Deformace úhlu mezi oběma vazbami je způsobena tím, že dva nevazebné elektronové páry v HAO mířící do vrcholů tetraedru více odpuzují, než vazebné páry v MO mířící do zbývajících vrcholů tetraedru. V molekule vznikají důsledkem sdílení elektronů mezi atomy vodíku a kyslíku kovalentní vazby, jedná se o poměrně silné chemické vazby.
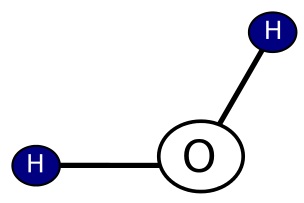
Molekula vody
Obrázek molekula vody od VNB
Polarita
Jelikož molekula vody není lineární, dochází ke vzniku nepatrného záporného náboje u atomu kyslíku a nepatrného kladného náboje u atomů vodíku – vznik elektrické polarity. V případě molekuly vody hovoříme o bipolaritě. Molekula vody je tedy bipolární.
Vodíkové můstky
Bipolární molekuly vody se navzájem přitahují. Pozitivně nabité konce molekuly (atomy vodíku) jsou přitahovány k negativně nabitému konci (atomu kyslíku) jiné molekuly. Tyto vodíkové můstky způsobují vzájemnou soudržnost molekul vody = koheze. Přilnavost molekul vody k jiným povrchů nazýváme adheze. Síla těchto můstků také vytváří na rozhraní mezi plynným a kapalným prostředím povrchové napětí. Povrchové napětí poskytuje řadě vodních organismů stabilizační plochu a oporu k trvalému nebo přechodnému pobytu. Díky tomuto napětí se mohou např. vodoměrky pohybovat po její hladině, zatímco jiné organismy se mohou držet zespodu.
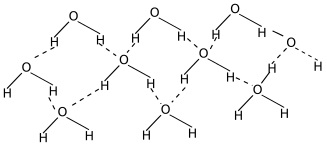
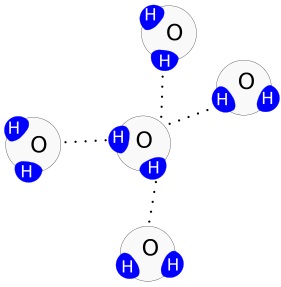
Znázornění vodíkových můstků mezi polárními molekulami vody
Obrázky Podoba molekul vody od VNB
Rozpouštědlo
Molekuly vody se k sobě nepřitahují jen navzájem, ale působí také i na ostatní molekuly polárních sloučenin. Voda dokáže rozpustit daleko více látek než kterákoli jiná kapalina, proto také označení „univerzální rozpouštědlo“. Z tohoto důvodu obsahuje oceán velké množství rozpuštěného materiálu (padesát milionů trilionu tun soli – díky které je mořská voda slaná). Voda v sobě rozpouští jak živiny potřebné pro řasy, tak kyslík nezbytný pro mnoho organismů.
Skupenské teplo
Voda má vysoké skupenské teplo tuhnutí a varu. Vysoké skupenské teplo tání a varu je výsledkem vzájemných vazeb vody vodíkovými můstky. Během koloběhu vypařování a kondenzace vody v přírodě dochází k výměně obrovského množství tepelné energie, bez něhož by Země nebyla obyvatelná. Energie vyzařovaná sluncem zůstává z části uchována v oceánech. Evaporací je tato „skladovaná“ energie oceánům odebírána a přenášena vysoko do atmosféry, kde v jejich horních vrstvách díky nízké teplotě kondenzuje a vytváří mraky. Ty přinášejí atmosférické srážky, při nichž dochází k uvolňování skupenského tepla kondenzace.
Měrná tepelná kapacita vody
Měrná tepelná kapacita vody je množství tepla potřebné k ohřátí 1 kg vody o 1 °C, při 15 °C je třeba dodat 4,186 kJ. Voda tedy velmi dobře odolává změnám teploty okolí. Vysoké specifické teplo vody znamená, že ohřáté masy vody působí jako akumulátor tepla, které může být opět uvolňováno do okolního prostředí v době ochlazení.
Tepelná vodivost vody
Tepelná vodivost vody je velmi malá, proto je molekulární přenos tepla vodou i na malé vzdálenosti bezvýznamný. Vertikální i horizontální rozvod tepla ve vodních nádržích se děje převážně prouděním.
Hustota
Maximální hustoty dosahuje voda při teplotě 3,94 °C (1000 kg/ m3). Studenější i teplejší voda je proto lehčí. Tento jev se nazývá teplotní anomálie vody. Pod teplotou 4 °C hustota vody klesá, protože ve vodě začínají převládat shluky molekul s jinou strukturou, kde jsou jednotlivé molekuly dále od sebe. Struktura molekuly ledu je ještě více odlišná – v šesterečné mřížce ledu jsou molekuly nejdále od sebe, proto zmrznutím vody nabude led na objemu o celých 9 % a na vodě plave. Velká hustota vody má vliv na stavbu těla vodních živočichů. Hustota těla vodních živočichů je blízká hustotě vody. Vodním živočichům proto stačí k zajištění opory a pohybu méně výkonné pohybové orgány a slaběji vytvořené kostry než živočichům suchozemským. V mnoha případech dosahují i větších rozměrů než jejich příbuzné suchozemské formy.
Viskozita
Viskozita (neboli vnitřní tření) charakterizuje odpor, který klade voda vlastnímu pohybu (toku). Tedy mezi pohybem vody a vodním organismem působí brzdící síla (tření). To má výrazný vliv na plovoucí a vznášející se organismy. Viskozita vody je asi 100 krát větší než viskozita vzduchu a je výrazně ovlivňována teplotou. Tj. v teplé vodě se organismy pohybují s menším výdajem energie, ale současně rychleji sedimentují než v chladné vodě (teplá voda má menší hustotu).
Význam a použití vody
- Je základní podmínkou života. Jde o rozpouštědlo, ve kterém probíhají veškeré chemické děje v organismech.
- Je nezbytná pro naše tělo - pomáhá regulovat tělesnou teplotu a umožňuje trávicí procesy. Díky pravidelné výměně vody můžeme z těla vyplavovat škodlivé látky.
- Pomáhá dopravovat látky v rostlinách.
- Je zdrojem H+ při fotosyntéze.
- Pro mnoho druhů organismů je prostředím, kde žijí.
- Jde o nejdůležitější surovinu všech průmyslových odvětví, používá se ke chlazení, ohřevu, oplachu, k výrobě elektrické energie ve formě páry a v potravinářství k výrobě všech nápojů atd.
- Je základní podmínkou rostlinné a živočišné výroby.
- Stala se zdrojem obživy v přímořských státech.
- Vodní toky (řeky) a plochy (oceány, moře, jezera, velké rybníky) hrají významnou roli v dopravě.
- Přítomnost vodních ploch má v krajině vliv na klima i mikroklima.
- Voda je využívána při osobní hygieně, rekreaci a sportu.
- Minerální voda má léčivé účinky.
Pohyb vody v rostlinách
Vodní režim rostliny zahrnuje příjem vody rostlinou z okolního prostředí, vedení (pohyb) vody v rostlině a výdej vody z rostliny do okolního prostředí. Rostlina vodu neustále přijímá a vydává. Rostliny obsahují cca 70 % vody. Nejvíce vody obsahují plody a zásobní orgány (90 %), nejméně semena (5 %). Rostliny přijímají vodu kořeny a orgány bez kutikuly (listy vodních rostlin). V rostlině voda proudí transpiračním proudem (xylémem). Voda z rostliny se zároveň s příjmem vypařuje přes průduchy a kutikulu.
Většina rostlin má tkáně nazývané dřevo (xylém) a lýko (floém), které dopravují vodu a živiny do všech částí rostliny. Xylém se skládá z kanálků dopravujících vodu od kořenů vzhůru a floém rozvádí živiny po celé rostlině. Xylém a floém tvoří shluky nazývané cévní svazky. Ty vyztužují rostlinu – zejména dřevité stěny jejich xylémových kanálků.
Zdravé rostlinné buňky mají dostatek vody, která vytváří vnitřní tlak, takže každá buňka je pevnou součástí rostlinného pletiva. Jestliže však rostlina ztratí příliš mnoho vody, buňky „změknou“ a přestanou na sebe tlačit. Rostlina pak ochabne a zvadne. K tomu dochází často v létě, kdy kvůli vysokým teplotám vysychá půda.
I rostliny se mohou pohybovat. Pohyby spojené s odpařováním vody se nazývají fyzikální. Tyto pohyby působí i v neživých částech rostliny. Jsou podmíněné fyzikálními jevy a bývají v souvislosti se šířením spor nebo semen.
Hygroskopické pohyby jsou způsobeny pnutím, které vzniká na základě rozdílu v rychlosti bobtnání a propustnosti buněčných stěn pro vodu u rostlinných pletiv vně a na vnitřní straně pohybujícího se orgánu. Různé části rostliny mají odlišnou schopnost sát vodu. Části rostliny mění svůj tvar, např. šišky jehličnanů se za sucha rozevírají, za vlhka naopak zavírají, v důsledku čehož dochází k uvolňování a vypadávání zralých semen. Uvedené pohyby jsou způsobeny rozdílným bobtnáním pletiva na vnitřní a vnější straně semenných šupin.

Hygroskopické pohyby šišky
Obrázky Focus stacked pine cone od Uberprutser [CC BY-SA 3.0], via Wikimedia Commons; Pine cone from california beach 1 od By Mbz1 [CC BY-SA 4.0-3.0-2.5-2.0-1.0], via Wikimedia Commons
Pokud vás téma zaujalo a chcete se dozvědět více:
- http://cs.wikipedia.org/wiki/Voda
- http://www.clearbiology.com/biochemistry-review-activity/
- http://www.wyzant.com/resources/lessons/science/biology/properties-of-water
- http://cs.wikipedia.org/wiki/Vod%C3%ADkov%C3%A1_vazba
- http://cs.wikipedia.org/wiki/Molekula
- https://sites.google.com/site/dochepo/seznam-pokusua/pohyb-vody
- http://www.sikovny-cvrcek.cz/siska-ve-vode
- http://www.biology.webz.cz/pohyb.php
- http://kfrserver.natur.cuni.cz/lide/edmunz/praktika_fr/mb130c14/navody/4_vodnirezim_odbornici.pdf
- http://www.odpovedi.cz/otazky/proc-se-siska-borovice-cerne-ve-vode-smrskne
- http://www.euroekonom.sk/download2/testy-prijimacky-vs-biologia/Biologia-BRNO-14biol.pdf
- http://www.gymh.cz/vyuka/biologie/prehledy/2bot_4_rust_vyvoj.pdf
- https://en.wikipedia.org/wiki/Hygroscopy
- https://en.wikipedia.org/wiki/Water
- Frith A. a kol. (2012): Poznej svět kolem nás. Svojka, Praha, 288 s. ISBN: 978-80-256-0574-5.
Potřebujete poradit? Napište nám na info@vedanasbavi.cz
